ウイルスの宿主細胞感染性をハイスループットに測定
近赤外蛍光イメージングスキャナー
Odyssey DLx
ウイルスは細胞に感染すると宿主細胞の遺伝子発現システムを利用して自らのウイルスタンパク質を生産しウイルス粒子を複製します。
これまでウイルスの宿主細胞感染性の評価は、プラークアッセイ法、FFU法、リアルタイムPCR法、ELISA法などで行われてきました。
LI-COR社のIn-Cell Western アッセイ法は、これまでの方法に対して多くの利点を持つ新たなアッセイ手法です。
宿主細胞におけるウイルスタンパク質の発現を96ウェルプレートを用いてセルベースでハイスループットに測定していただくことが可能になります。
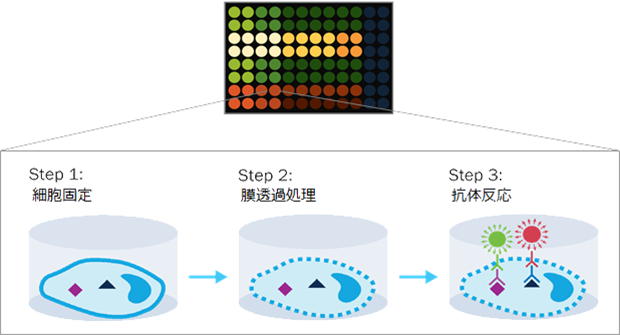
In-Cell Western アッセイ法
In-Cell Westernアッセイでは、ウイルスタンパク質に対する抗体を用いて96ウェルプレートで蛍光免疫染色を行い、ウェルの蛍光強度を測定します。
そのため、細胞からのタンパク質抽出を行うことなくセルベースで、しかもハイスループットに、ウイルスタンパク質の発現を解析することが可能です。
In-Cell Western アッセイ vs プラークアッセイ
一方で、 In-Cell Western アッセイ法はプラークアッセイ法に対して下記のような利点がございます。
- 寒天培地の重層が不要
- 目視によるカウントに頼らず客観的なデータアウトプットが可能
- 96ウェルプレート(あるいは384ウェルプレート)によるハイスループットなアッセイが可能
- ウイルス(+ワクチン/薬剤/中和抗体)を添加してから早期にウイルス感染性を評価できる
- 細胞溶解(細胞死)を引き起こさないウイルスでも測定可能
In-Cell Western アッセイはプラークアッセイ法とデータの相関があることがいくつかの論文で示されています。
Fabiani, M., et. al 1 は、10倍希釈系列の1型単純ヘルペスウイルス液(HSV-1)をVero細胞に感染させ、それぞれIn-Cell Western アッセイ法とプラークアッセイ法(PFU)で測定しました。
2つの方法のデータに高い相関性が確認された一方で、In-Cell Western アッセイ法はプラークアッセイ法よりも早期にウイルスの感染を検出できることが示されました。
プラークアッセイではウイルス添加後48-72時間の培養が必要であったのに対し、 In-Cell Western アッセイ法ではウイルス添加24時間後に測定が可能でした。
また、In-Cell Western アッセイはウェルの蛍光強度を測定するため、プラークアッセイのように多くのプラークを目視でカウントする必要がありません。
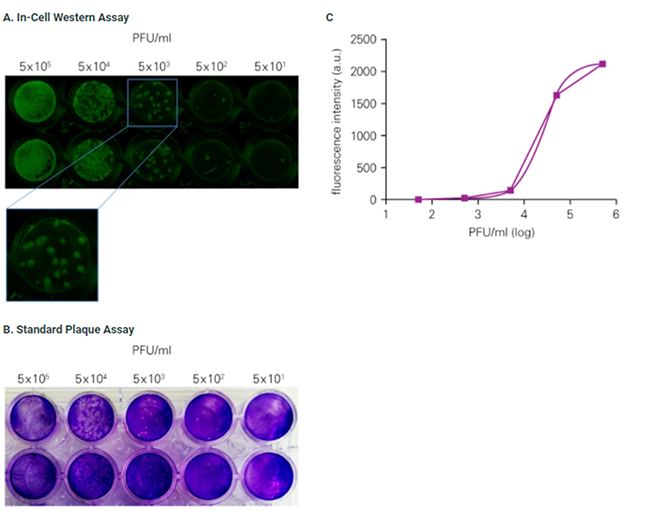
| Figure 1. The In-Cell Western Assay is a suitable technique to detect HSV-1 infection in cells. Vero cells were seeded in 96-well plates and infected with HSV-1 in 10-fold serial dilutions. A) Cells were fixed and immunostained 24 hours post-infection with anti-gB antibody followed by IRDye® 800CW Goat anti-Mouse Secondary Antibody. Plates were imaged using an Odyssey Imager with a representative image shown. B) A representative image of SPA performed using the same HSV-1 dilutions used for the In-Cell Western Assay. C) Standard curve for the mean value of fluorescence intensity detected for each point. |
In-Cell Western アッセイ vs qRT-PCR / ELISA / フローサイトメトリー
プラークアッセイ法は細胞溶解を引き起こさないウイルスでは測定ができません。従来そのようなウイルスの力価測定には、qRT-PCR法、ELISA法、フローサイトメトリー法などが使われてきました。
ハンタンウイルス(Hantaan Virus; HTNV)は細胞溶解を伴わないウイルスの1つです。
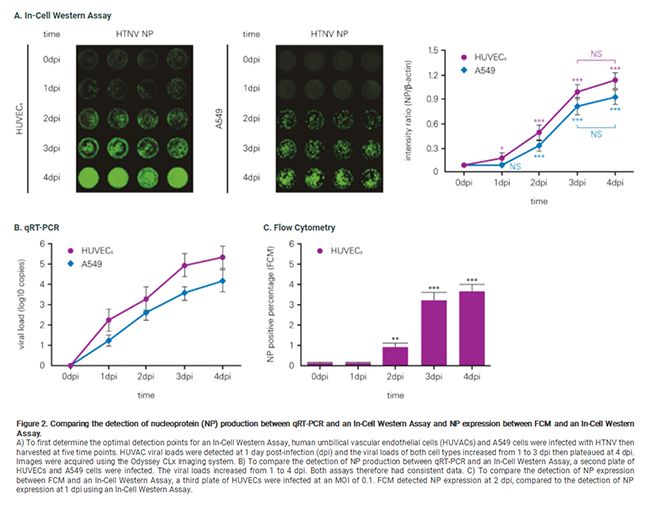
Ma, H.W., et. Al 2 は、HTNVの力価をIn-Cell Western アッセイ法、定量PCR法(qRT-PCR)、フローサイトメトリー法、ELISA法で比較しました。
その結果、 In-Cell Western アッセイ法は、定量PCR法およびELISA法と同等の感度、フローサイトメトリー法よりも優れたアッセイ感度を持つことが示されました。
また、ELISA法と異なりセルベースでのアッセイが可能で、タンパク質抽出のステップが不要というメリットがあります。
“ For viral titer assessment, the TCID50 detected by the ICW assay was more convenient and rapid than the ELISA-based TCID50 assay. ”ー Ma 2
下図は定量PCR法およびフローサイトメトリー法との比較です。dpiはday post infectionの略です。
さらに、ELISA法との比較も行いました。

HTNVに対する中和抗体活性をIn-Cell Western アッセイ法とELISA法で比較しました。
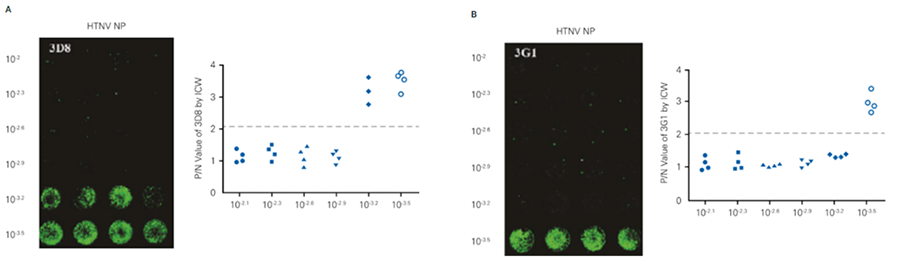
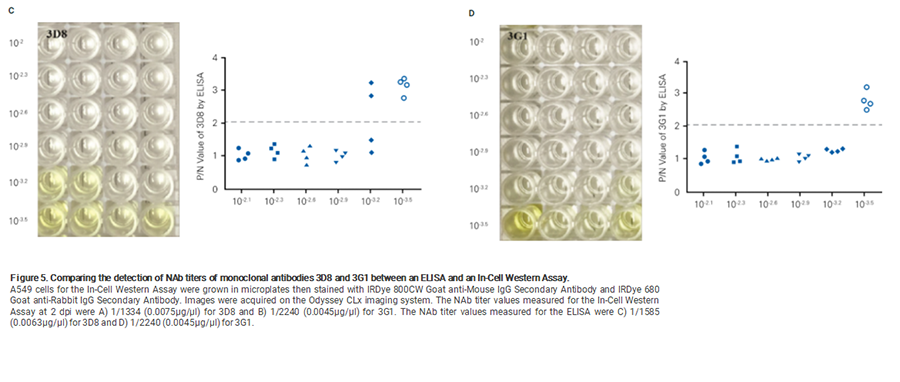
他法との比較表
| プラークアッセイ | 定量PCR | ELISA | In-Cell Western | |
|---|---|---|---|---|
| 測定対象 | 細胞変性 | mRNA発現 | タンパク質発現 | タンパク質発現 |
| 96ウェル測定 | 不可 | 可 | 可 | 可 |
| 測定の手間 | とても煩雑 | 簡単 | 簡単 | 簡単 |
| 寒天培地の重層 | 必要 | 不要 | 不要 | 不要 |
| データの客観性 | 低い | 高い | 高い | 高い |
| 細胞溶解を引き起こ さないウイルスの測定 |
不可 | 可 | 可 | 可 |
| 測定までの培養日数 | 3-7日 | 1-3日 | 1-3日 | 1-3日 |
| セルベース | 〇 | × | × | 〇 |
| RNAやタンパク質の 抽出 |
ー | 必要 | 必要 | 不要 |
| ウイルスに対する 特異プローブ |
不要 | 必要 | 必要 | 必要 |
ウェビナー

測定装置
| Odyssey DLx イメージングシステム | |
| Odyssey DLx イメージングシステムは、In-Cell Western アッセイ(セルベースELISA)と蛍光ウェスタンブロッティングの世界標準機です。励起光源として近赤外蛍光波長のレーザー(685nmおよび785nm)を搭載し、プレート由来および細胞由来の自家蛍光を最大限に排除することで高感度なIn-Cell Western アッセイ を行っていいただけます。また、定量性と再現性に優れたウェスタンブロット実験を行っていただくことができます。 |
新型コロナウイルス研究に関連したその他の製品
| リアルタイム細胞アナライザー xCELLigenceシリーズ |
超高感度ELISA Simoaシリーズ |
シングルセル解析プラットフォーム Chromium シリーズ |
| プラークアッセイはやりたくない、そんな方は必見です。ウイルスやワクチンの力価をラベルフリーで96ウェル同時に自動測定できます。寒天培地の重層や目視によるカウントを必要としません。 | 新型コロナウイルス感染に伴うサイトカインストームを超高感度に測定できます。また、抗原タンパク質やセロコンバージョンの高感度検出も可能です。 | 新型コロナウイルス感染に伴う宿主免疫応答をシングルセルで高精度に解析します。コロナウイルスの基礎的知見を得るだけでなく中和抗体の開発にもお役立ていただけます。 |
| 核酸自動抽出装置 Nextractor NX-48S |
リアルタイムPCR Micシリーズ |
自動チップウォッシャー TipNovusシリーズ |
| 新型コロナウイルス核酸を約25分で48サンプル同時に抽出できる核酸自動抽出装置です。 | 全世界で数百台の装置が新型コロナウイルスののPCRテストに使用されています。富士フイルム和光純薬社のqPCRキットと組み合わせて使用すると、約42分で48検体の測定を完了できます。極めて小型のため、置き場所を選ばず、持ち運んで使用することもできます。 |
「チップの供給が足りなくなっている」 今の時代チップは洗って使い回せます。自動分注チップと洗浄して使いまわすための自動チップ洗浄ステーションです。 |
資料ダウンロード
In-Cell Western アッセイ法を用いたウイルス研究分野の論文例
- Fabiani, M., et. al. (2017).
A Novel Method to Titrate Herpes Simplex Virus-1 (HSV-1) Using Laser-Based Scanning of Near-Infrared Fluorophores Conjugated Antibodies.
Frontiers in Microbiology, 8(1085). DOI: 10.3389/fmicb.2017.01085 - Ma, H. W., et. al. (2017).
In-Cell Western Assays to Evaluate Hantaan Virus Replication as a Novel Approach to Screen Antiviral Molecules and Detect Neutralizing Antibody Titers.
Frontiers in Cellular and Infection Microbiology, 7(269). DOI: 10.3389/fcimb.2017.00269 - Weldon, S.K., et. al. (2010).
Quantitation of virus using laser-based scanning of near-infrared fluorophores replaces manual plate reading in a virus titration assay.
Journal of Virological Methods, 168(1–2), 57–62. DOI: 10.1016/j.jviromet.2010.04.016 - DuShane, J.K., et. al. (2019).
High-Throughput Characterization of Viral and Cellular Protein Expression Patterns During JC Polyomavirus Infection.
Frontiers in Microbiology, 10(783). DOI: 10.3389/fmicb.2019.00783 - Banerjee, A., et al. (2020).
Positive Selection of a Serine Residue in Bat IRF3 Confers Enhanced Antiviral Protection.
iScience, 23(3), 100958. DOI: 10.1016/j.isci.2020.100958 - Walls, A., et al. (2020).
Structure, Function, and Antigenicity of the SARSCoV-2 Spike Glycoprotein.
Cell, 180, 1-12. DOI: 10.1016/j.cell.2020.02.058 - Dijkman, R., et. al. (2012).
Replication-dependent downregulation of cellular angiotensin-converting enzyme 2 protein expression by human coronavirus NL63.
Journal of General Virology, 93(9), 1924–1929. DOI: 10.1099/vir.0.043919-0 - McCormick, D. et. al. (2018).
Identification of Host Factors Involved in Human Cytomegalovirus Replication, Assembly, and Egress Using a Two-Step Small Interfering RNA Screen.
mBio, 9(3), e00716-18. DOI: 10.1128/mBio.00716-18 - Sklan, E. H. et. al. (2007).
A Rab-GAP TBC Domain Protein Binds Hepatitis C Virus NS5A and Mediates Viral Replication.
Journal of Virology, 81(20), 11096–11105. DOI: 10.1128/JVI.01249-07
新型コロナウイルス研究に関連したその他の製品
リアルタイム細胞アナライザー
xCELLigenceシリーズ
プラークアッセイはやりたくない、そんな方は必見です。ウイルスやワクチンの力価をラベルフリーで96ウェル同時に自動測定できます。寒天培地の重層や目視によるカウントを必要としません。