ウイルスによる細胞変性効果をラベルフリーでハイスループットに測定
リアルタイム細胞アナライザー
xCELLigence シリーズ
新型コロナウイルス(SARS-CoV-2)の感染は拡大を続け、未だ衰える気配を見せません。新型コロナウイルスに対する治療薬およびワクチンの開発は急務です。
Agilent Technologies社(旧ACEA Biosciences社)のリアルタイム細胞アナライザーxCELLigenceシステムは、ウイルスによる細胞変性効果を、これまでの方法よりも少ない手間でハイスループットに測定することができます。
抗ウイルス薬のスクリーニング、ワクチンのスクリーニング、中和抗体の検出・定量などのお仕事に理想的なシステムです。
プラークアッセイはもうやりたくない?
これまでウイルスの細胞変性効果の測定はプラークアッセイ法を中心に行われてきました。しかし、プラークアッセイ法は快適な優れた実験法とは言えないところがありました。
- 実験の手数が多くて手間がかかる
- 寒天培地の重層を手早く、しかも気泡ができないように行う必要があり気を遣う
- ハイスループットな実験が困難
- プラークの目視によるカウントが主観的になってしまう
xCELLigenceシステムを用いたラベルフリー&リアルタイム細胞解析法は下記の利点を持ち、プラークアッセイ法の課題を解決することができます。
|
ラベルフリー バイオセンサープレートを用いて細胞由来の電気抵抗値を測定することで細胞の形態変化や細胞溶解をモニタリングします。細胞をプレートに播種してウイルス(+薬剤/ワクチン/中和抗体など)を加えるだけで同一ウェルの経時データを自動で取得します。そのため測定の手間はミニマムです。寒天培地の重層も不要です。 |
 |
|
ハイスループット 96ウェルプレートあるいは384ウェルプレートを用いたハイスループットな実験が可能です。多くの薬剤、ワクチン、中和抗体を1枚のプレートで1度にテストできます。 |
|
|
客観的 目視による判断ではなくウェル全域に由来する電気抵抗値の変化を自動で測定します。そのため客観的で再現性の高いデータアウトプットが可能です。 |
|
|
カイネティックデータ 1つのタイムポイントのデータではなく同一ウェルの経時的なデータを得られます。抗ウイルス薬などの効果を見逃さず薬理活性や中和活性を正確に評価することができます。 |
| Publication Pick-Up | Vaccine and Virology Handbook |
| 新型コロナウイルスのSタンパク質に対するモノクローナル抗体を迅速に取得しプロファイリングするための方法論が記された論文です。抗体の中和活性試験をハイスループットに行う手法としてxCELLigenceシステムが採用されています。 | ウイルス研究とワクチン研究分野のハンドブックです。xCELLigenceシステムを用いた多くのデータ例が紹介されています。 |
| 論文を見る | ダウンロードする |
xCELLigenceシステムを用いたCOVID-19研究論文リストはこちら
xCELLigenceによるラベルフリー&リアルタイム細胞解析
xCELLigenceシステムは、ウイルスの細胞変性効果を、培養を続けながらリアルタイムに計測します。細胞をウェルに撒いてウイルス(+薬剤/ワクチン/中和抗体など)を加えた後は、放置しておくだけで細胞溶解と細胞形態変化を自動的に計測できます。
測定は専用の96ウェル(あるいは16ウェル/384ウェル)バイオセンサープレートを用いてハイスループットに実施できます。主観に頼らない客観的なリードアウトにより、目視プラークカウントの手間と主観に頼る判断を排除できます。
 |
ステップ1:E-Plateで細胞を培養する |
| 接着系細胞を専用のバイオセンサープレート(E-Plate)に播種します。 E-Plateは、細胞に影響しない超微弱な電流をかけることにより、細胞由来の電気抵抗値の測定を可能にします。 |
|
 |
ステップ2:ウイルスを加える |
| 細胞をウイルスに感染させます。このとき、抗ウイルス薬、ワクチン、中和抗体などを一緒に加えることも可能です。 | |
 |
ステップ3:細胞変性効果をリアルタイムモニタリングする |
| 培養インキュベーターの中で細胞溶解や細胞変性を自動的に計測します。自動測定なので解析の手間が少ないだけでなく、感染性サンプルを触るリスクを最小限にすることができます。 |
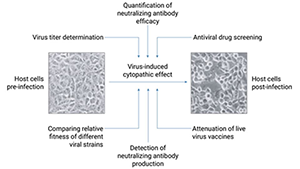
ウイルス/ワクチン研究分野のアプリケーション例
xCELLigenceシステムはウイルス学における様々な目的でご使用いただくことができます。
| ウイルス力価測定 | 中和抗体の検出と定量 | 抗ウイルス薬の 薬効評価 |
ウイルスフィットネスの比較 | 殺ウイルス剤の効能測定 |
活用例①:ウイルス力価の測定
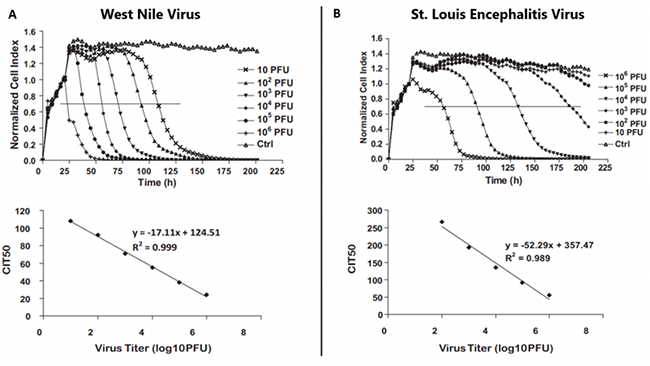 Figure reprinted from Journal of Virological Methods, volume 173(2), Fang, Y. et al., “Real-Time Monitoring of Flavivirus Induced Cytopathogenesis Using Cell Electric Impedance Technology,” pages 251–8. Copyright 2011, with permission from Elsevier. |
|
xCELLigence システムによるウイルス力価の測定 図A:Vero細胞に異なるPFUのウェストナイルウイルス液(WNV)をかけて電気抵抗値の変化を長期にわたり追跡しました。上段の図は細胞変性効果のリアルタイムモニタリングです。横軸が時間、縦軸がノーマライズ後の電気抵抗値です。水平方向のラインは50%の細胞が死滅したラインです。下段の図は50%の細胞が死滅するまでに要した時間(CIT50)とPFUのプロットです。 図B:セントルイス脳炎ウイルス(SLEV)を用いて同様の実験を行った結果です。 AとBのどちらの実験でもCIT50がPFUに対して負の相関を持ち、CIT50を用いてウイルスあるいはワクチンの力価を評価できることが示されました。 |
ウイルス(ワクチン)の力価測定の論文例
- Gilchuk, P. et al. Analysis of a Therapeutic Antibody Cocktail Reveals Determinants for Cooperative and Broad Ebolavirus Neutralization. Immunity. 2020 Feb, 52(2): 388 – 403.
- Caliaro, O. et al. Phenotypic testing of patient herpes simplex virus type 1 and 2 isolates for acyclovir resistance by a novel method based on real-time cell analysis. J Clin Virol. 2020 Feb, 125:104303. doi: 10.1016/j.jcv.2020.104303. [Epub ahead of print]
- Thieulent, Côme J. et al. Screening and Evaluation of Antiviral Compounds Against Equid Alpha-Herpesviruses Using an Impedance-Based Cellular Assay. Virology 2019 Jan, 526: 105–116.
- Charretier, C. et al. Robust Real-Time Cell Analysis Method for Determining Viral Infectious Titers During Development of a Viral Vaccine Production Process.J. Virol. Methods 2017 Nov 14, 252, 57–64.
- Fang, Y. et al. Real-Time Monitoring of Flavivirus Induced Cytopathogenesis Using Cell Electric Impedance Technology. J. Virol. Methods 2011 May, 173(2), 251–8.
- Witkowski, P. T. et al. Cellular Impedance Measurement as a New Tool for Poxvirus Titration, Antibody Neutralization Testing and Evaluation of Antiviral Substances. Biochem. Biophys. Res. Commun. 2010 Oct 8, 401(1), 37–41.
活用例②:中和抗体の検出と定量
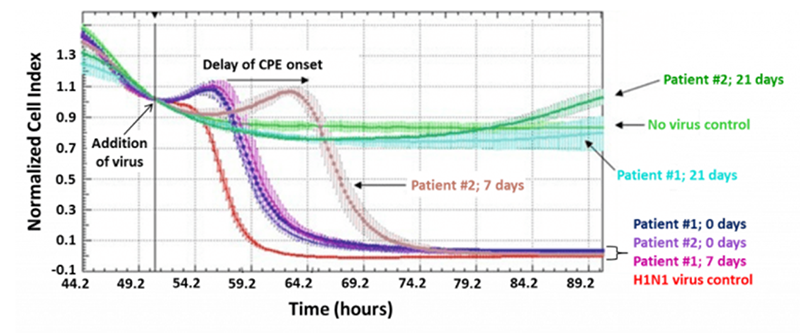 Figure adapted from Asia Pacific Biotech News, volume 14(10), Lu, H. et al. “Label-free Real-time Cell Based Assay System for Evaluating H1N1 Vaccination Success,” pages 31–32. Copyright 2010, with permission from Asia Pacific Biotech News |
|
xCELLigence システムによる中和試験の測定例 H1N1インフルエンザワクチン接種を受けた2人の被験者(Patient #1と#2)から、ワクチン接種前(0 days)、ワクチン接種7日後(7 days)、ワクチン接種21日後に血清を採取した。血清を精製H1N1インフルエンザワクチンと混合し、E-Plateで培養中の細胞に添加した後、xCELLigenceを用いてそのままモニタリングした。 Patient #2では、ワクチン接種7日後の血清でCPEの著しい遅延が認められ、ワクチン接種7日目の時点で血清中に中和抗体が存在していることがわかる。一方でPatient #1では、ワクチン接種7日目の血清ではCPE遅延がみられず、セロコンバージョンが起きていないことが推察される。 |
中和試験の論文例
- Gilchuk, P. et al. Analysis of a Therapeutic Antibody Cocktail Reveals Determinants for Cooperative and Broad Ebolavirus Neutralization. Immunity. 2020 Feb, 52(2): 388 – 403.
- Fang, Y. et al. Real-Time Monitoring of Flavivirus Induced Cytopathogenesis Using Cell Electric Impedance Technology. J. Virol. Methods 2011 May, 173(2), 251–8.
- Hongzhou Lu and Xiao Xu Label-free Real-time Cell Based Assay System for Evaluating H1N1 Vaccination Success. Asia Pacific Biotech News 2010, 14(10), 31–32.
- Teng, Z. et al. Real-Time Cell Analysis–a New Method for Dynamic, Quantitative Measurement of Infectious Viruses and Antiserum Neutralizing Activity. Virol. Methods 2013 Nov, 193(2), 364–70.
- Kashima, K. et al. Inhibition of Metastasis of Rhabdomyosarcoma by a Novel Neutralizing Antibody to CXC Chemokine Receptor-4. Cancer Sci. 2014 Oct, 105(10), 1343–50.
- Tian, D. et al. Novel, Real-Time Cell Analysis for Measuring Viral Cytopathogenesis and the Efficacy of Neutralizing Antibodies to the 2009 Influenza A (H1N1) Virus. PLoS One 2012, 7(2), e31965.
活用例③:抗ウイルス薬の薬効測定
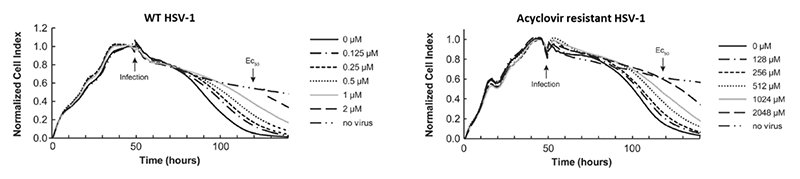 Data adapted from the Journal of Clinical Microbiology, volume 54(8), Piret, J. et al. “Novel Method Based on Real-Time Cell Analysis for Drug Susceptibility Testing of Herpes Simplex Virus and Human Cytomegalovirus.” Copyright 2016, with permission from American Society for Microbiology. |
|
xCELLigence システムによる1型単純ヘルペスウイルス(HSV-1)に対する抗ウイルス薬の薬効評価 E-PlateにVero細胞を播種してコンフルエントまで培養したのちにHSV-1に感染させた。90分後に薬剤を添加してxCELLigenceシステムで抗ウイルス活性をモニタリングした。 左図:野生型HSV-1 右図:アシクロビル耐性変異型HSV-1 アシクロビル耐性変異型HSV-1の細胞変性効果を抑制するには、野生型HSV-1と比べてはるかに高濃度の薬剤添加が必要であることがわかる。本データからそれぞれのEC50を算出した結果、野生型HSV-1の0.8 μMに対し耐性変異型HSV-1におけるEC50は100 μMであった。 |
抗ウイルス薬開発の論文例
- Côme J Thieulent. et al. Identification of antiviral compounds against equid herpesvirus-1 using real-time cell assay screening: Efficacy of decitabine and valganciclovir alone or in combination. Antiviral Res 2020 Sep 11;183:104931. doi: 10.1016/j.antiviral.2020.104931. Online ahead of print.
- Caliaro, O. et al. Phenotypic testing of patient herpes simplex virus type 1 and 2 isolates for acyclovir resistance by a novel method based on real-time cell analysis.J Clin Virol. 2020 Feb, 125:104303. doi: 10.1016/j.jcv.2020.104303. [Epub ahead of print]
- Côme J Thieulent. et al. Screening and evaluation of antiviral compounds against Equid alpha-herpesviruses using an impedance-based cellular assay. Virology 2019 Jan 2;526:105-116. doi: 10.1016/j.virol.2018.10.013. Epub 2018 Oct 26.
- Prasad, V. et al. Cell Cycle-Dependent Kinase Cdk9 Is a Postexposure Drug Target Against Human Adenoviruses. ACS Infect. Dis. 2017 Jun 9, 3(6), 398–405
- Watterson, D. et al. A Generic Screening Platform For Inhibitors of Virus Induced Cell Fusion Using Cellular Electrical Impedance. Sci. Rep. 2016 Mar 15, 6, 22791.
- Zandi, K. A Real-Time Cell Analyzing Assay for Identification of Novel Antiviral Compounds against Chikungunya Virus. Methods Mol. Biol. 2016, 1426, 255–62.
- Sharma, B. N. et al. Antiviral Effects of Artesunate on Polyomavirus BK Replication in Primary Human Kidney Cell. Antimicrob. Agents Chemother. 2014, 58(1), 279–89.
- Piret, J. et al. Novel Method Based on Real-Time Cell Analysis for Drug Susceptibility Testing of Herpes Simplex Virus and Human Cytomegalovirus. J. Clin. Microbiol. 2016 Aug, 54(8), 2120–7.
- Cymerys, J. et al. Primary Cultures of Murine Neurons for Studying Herpes Simplex Virus 1 Infection and Its Inhibition by Antivirals. Acta Virol. 2013, 57(3), 339–45.
- Witkowski, P. T. et al. Cellular Impedance Measurement as a New Tool for Poxvirus Titration, Antibody Neutralization Testing and Evaluation of Antiviral Substances. Biochem. Biophys. Res. Commun. 2010 Oct 8, 401(1), 37–41.
Vaccine & Virology ハンドブックをダウンロードする
活用例④:ウイルスフィットネスの比較
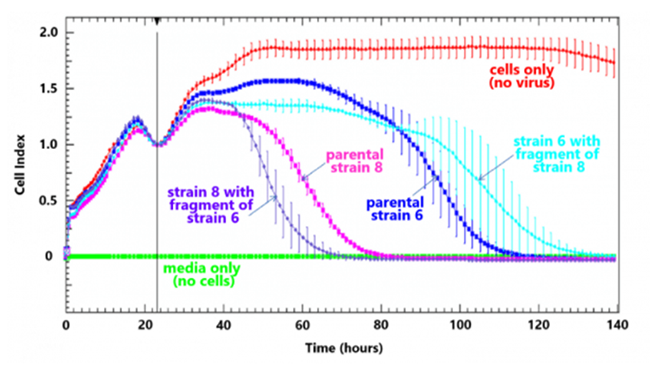 Figure reprinted from Veterinary Microbiology, volume 171 (1-2), Coetzee, P. et al. “Viral Replication Kinetics and In Vitro Cytopathogenicity of Parental and Reassortant Strains of Bluetongue Virus Serotype 1, 6 and 8,” pages 53–65. Copyright 2014, with permission from Elsevier. |
|
xCELLigence システムによるウイルスフィットネスの比較 E-PlateにVero細胞を播種してコンフルエントまで培養したのちに特定のMOIでブルータングウイルスを感染させ、xCELLigenceシステムで細胞変性効果をモニタリングした。ゲノム再構成されたブルータングウイルスの複製能つまりフィットネスを親株(Parental)と比較した。xCELLigenceによる経時的データによりエンドポイントアッセイでは難しいウイルス複製能の比較が可能である。 |
ウイルスフィットネス比較の論文例
- Yu, P. et al. CD163 ΔSRCR5 MARC-145 Cells Resist PRRSV-2 Infection via Inhibiting Virus Uncoating, Which Requires the Interaction of CD163 With Calpain 1. Front Microbiol. 2020 Jan, 10:3115. doi: 10.3389/fmicb.2019.03115. eCollection 2019.
- Lübke, M. et al. Identification of HCMV-derived T cell epitopes in seropositive individuals through viral deletion models.J Exp Med. 2020 Mar, 217(3). pii: e20191164. doi: 10.1084/jem.20191164.
- Sung-Hyun, K. et al. Specific Nucleotides at the 3’-Terminal Promoter of Viral Hemorrhagic Septicemia Virus are Important for Virulence In Vitro and In Vivo . Virology 2015 Feb, 476, 226–32.
- Coetzee, P. et al. Viral Replication Kinetics and In Vitro Cytopathogenicity of Parental and Reassortant Strains of Bluetongue Virus Serotype 1, 6 and 8. Vet. Microbiol. 2014 Jun 25, 171(1-2), 53–65.
活用例⑤:殺ウイルス剤の効能評価
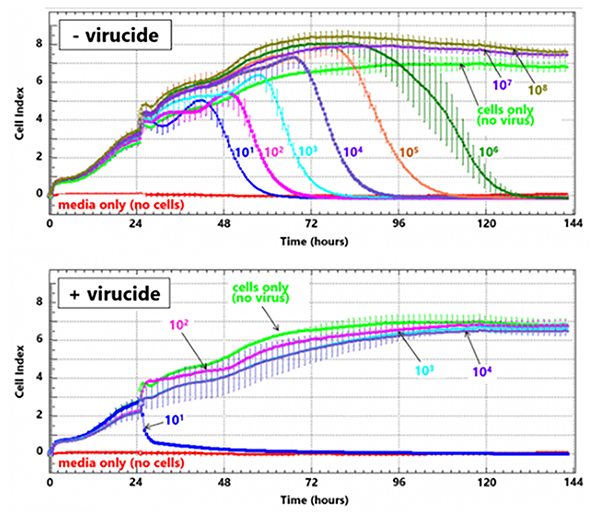 Reprinted from the Journal of Virological Methods, volume 199, Ebersohn, K. et al. “An Improved Method for Determining Virucidal Efficacy of a Chemical Disinfectant Using an Electrical Impedance Assay,” pages 25–28. Copyright 2014, with permission from Elsevier. |
|
xCELLigence システムによる抗ウイルス剤の効能評価 事前に抗ウイルス剤で処理した伝染性ファブリキウス嚢病ウイルス(IBDV)と処理していないウイルスを、様々な濃度でVero細胞に感染させ、xCELLigenceシステムで細胞変性効果をモニタリングした。抗ウイルス剤処理によりウイルスの細胞変性効果が減弱していることがわかる。それぞれの色のラインの数字はウイルス液の希釈率を示す。 |
抗ウイルス剤研究の論文例
- Ebersohn, K.; Coetzee, P.; Venter, E. H. An Improved Method for Determining Virucidal Efficacy of a Chemical Disinfectant Using an Electrical Impedance Assay. J. Virol. Methods. 2014 Apr, 199, 25–8.
Vaccine & Virology ハンドブックをダウンロードする
資料ダウンロード
|
Vaccine & Virology Handbook(英語ハンドブック) |
|
|
A New Way to Monitor Virus-Mediated Cytopathogenicity(英語アプリケーションノート) |
|
|
ウイルスの細胞変性効果(日本語アプリケーションフライヤー) |
測定装置(xCELLigence シリーズ)
CELLigenceシリーズは、バイオセンサー技術を用いて電気抵抗値をモニタリングすることにより、細胞数や細胞形態の変化を非染色でリアルタイムに測定します。測定は常にインキュベーターの中で行われます。同一ウェルの経時変化がPCにリアルタイムに記録されます。スループットの異なる複数の機種がラインナップされています。
| xCELLigence RTCA MP | xCELLigence RTCA SP | xCELLigence RTCA DP |
| 96 well plate x6枚 | 96 well plate x1枚 | 16 well plate x3枚 |
最新モデルであるxCELLigence eSightは、電気抵抗値に加えて同一ウェルからイメージングも行うことができます。電気抵抗値の変化に画像によるエビデンスを与えることができるだけでなく、適切な蛍光レポーターを用いることでMechanism of Actionに迫ることが可能です。
| xCELLigence RTCA eSight |
| 96 well plate x5枚 |
新型コロナウイルス研究に関連したその他の製品
| 近赤外蛍光スキャナー Odyssey CLx |
超高感度ELISA Simoaシリーズ |
シングルセル解析プラットフォーム Chromium Controller |
| 抗体検出により新型コロナウイルスの宿主細胞への感染をセルベースでハイスループットに測定することが可能です。 | 新型コロナウイルス感染に伴うサイトカインストームを超高感度に測定できます。また、抗原タンパク質やセロコンバージョンの高感度検出も可能です。 | 新型コロナウイルス感染に伴う宿主免疫応答をシングルセルで高精度に解析します。コロナウイルスの基礎的知見を得るだけでなく中和抗体の開発にもお役立ていただけます。 |
| 核酸自動抽出装置 Nextractor NX-48S |
リアルタイムPCR Micシリーズ |
自動チップウォッシャー TipNovusシリーズ |
| 新型コロナウイルス核酸を約25分で48サンプル同時に抽出できる核酸自動抽出装置です。 | 全世界で数百台の装置が新型コロナウイルスののPCRテストに使用されています。富士フイルム和光純薬社のqPCRキットと組み合わせて使用すると、約42分で48検体の測定を完了できます。極めて小型のため、置き場所を選ばず、持ち運んで使用することもできます。 |
「チップの供給が足りなくなっている」 今の時代チップは洗って使い回せます。自動分注チップと洗浄して使いまわすための自動チップ洗浄ステーションです。 |
製品/シリーズに関するお問い合わせ
製品に関するご質問や技術的なお問い合わせなどはこちらのフォームをご利用ください。